Menentukan Rumus Empiris Dan Rumus Molekul Lengkap - salam kimiaker, bagi para pecinta kimia kali ini saya akan membagikan sebuah artikel yang perlu kimiaker tahu, berkaitan dengan rumus, berikut penjelasannya.
Rumus Kimia
Rumus Kimia
Seperti yang telah disinggung rumus kimia merupakan salah satu ciri khas senyawa kimia. Rumus kimia suatu senyawa menyatakan lambang dan jumlah atom unsur yang menyusun suatu senyawa tanpa menyebut senyawa tersebut termasuk senyawa ionik atau kovalen. Rumus kimia sendiri terbagi menjadi rumus empiris dan rumus molekul.
Rumus molekul dan rumus empiris suatu senyawa hanya terjadi perbedaan jumlah atom, sedangkan atom unsur penyusun senyawa tetap. Namun demikian beberapa senyawa memiliki rumus molekul dan rumus empirisnya yang sama, misalnya H2O (air) dan NH3 (amoniak).
Jumlah atom dalam suatu rumus kimia menyatakan jumlah mol dari unsur terkait, jadi rumus kimia suatu senyawa merupakan perbandingan mol atom unsur penyusun senyawa tersebut. Dari perbandingan atom atau perbandingan mol ini dapat ditentukan perbandingan massa dan % massa dari unsur-unsur yang menyusun senyawa tersebut.
Untuk memperjelas hal ini perhatikan contoh berikut! misalnya vitamin C yang mengandung asam askorbat dengan rumus molekul C6H8O6, maka:
· Rumus molekul C6H8O6
· Perbandingan mol atom unsur
C : H : O = 6 : 8 : 6
· Perbandingan massa unsur
C : H : O = 6 x Ar. C : 8 x Ar.H : 6 x Ar.O
= (6 x 12) : (8 x 1) : (6 x 16)
= 72 : 8 : 96
· Jumlah perbandingan = Mr
72 + 8 + 96 = 176
· % massa masing-masing unsur
Berikut adalah rumus untuk menghitung % massa unsur dalam senyawa

Rumus Empiris dan Rumus Molekul
Rumus Empiris
Rumus empiris adalah rumus kimia yang menyatakan perbandingan terkecil jumlah atom-atom pembentuk senyawa. Misalnya senyawa etena yang memiliki rumus molekul C2H4, maka rumus empiris senyawa tersebut adalah CH2.
Dalam menentukan rumus empiris yang dicari terlebih dahulu adalah massa atau persentase massa dalam senyawa, kemudian dibagi dengan massa atom relatif (Ar) masing-masing unsur. artinya untuk menentukan rumus empiris yang perlu dicari adalah perbandingan mol dari unsur-unsur dalam senyawa tersebut.
Contoh
Suatu senyawa mengandugn 64,6 g natrium, 45,2 g belerang dan 90 g oksigen. Jika diketahui Ar.N = 23, Ar.S = 32, ddan Ar.O = 16. Maka tentukan rumus empiris senyawa tersebut?
Jawab
Jadi rumus empiris senyawa tersebut adalah Na2SO4.
Rumus Molekul
Rumus molekul adalah rumus kimia yang menyatakan jenis dan jumlah atom yang menyusun suatu senyawa. Misalnya: C2H4 (etena), CO(NH2)2 (urea) dan asam asetat atau asam cuka (CH3COOH). Rumus molekul dapat didefinisikan sebagai rumus kimia yang menyatakan perbandingan jumlah dan jenis atom sesungguhnya dari suatu senyawa.
Dari rumus molekul asam cuka diketahui bahwa rumus molekul tersebut tidak ditulis C2H4O2. Beberapa alasan rumus molekul asam cuka tidak ditulis demikian yaitu
1. Untuk membedakan dengan senyawa lain yang memiliki jumlah atom penyusun yang sama misalnya metil format (HCOOCH3).
2. Rumus molekul menggambarkan struktur molekul. Artinya dari rumus molekul kita dapat menunjukan atom-atom saling berikatan. Pada molekul asam cuka atom C yang pertama mengikat 3 atom H dan 1 atom C berikutnya dan atom C berikunya mengikat 2 atom O kemudian 1 atom O mengikat 1 atom H.
Contoh soal menentukan rumus molekul dari rumus empiris
200 g senyawa organik mempunyai massa molekul relatif = 180, senyawa ini terdiri dari 40% karbon, 6,6% hidrogen dan sisanya adalah oksigen. Jika diketahui Ar.C = 12, Ar.H = 1, dan Ar.O = 16. Maka tentukan rumus molekul senyawa ini?
Jawab
Jadi rumus empiris senyawa tersebut adalah CH2O
Dari rumus molekul yang telah diperoleh maka rumus molekul dapat ditentukan sbagai berikut
CH2O)n
(Ar C x n) + (2.Ar H x n) + (Ar.O) = Mr senyawa
12n + 2n + 16n = 180
30n = 180
n = 6
jadi rumus molekulnya adalah C6H12O6.
Menentukan Rumus Empiris dan Rumus Molekul Berdasarkan Ar dan Mr
Tentukan rumus molekul yang dimiliki senyawa dengan umus empiris CH, jika diketahui Mr senyawa tersebut adalah 78?
Jawab
Mr senyawa = (CH)n
78 = (12 + 1)n
78 = 13n
n = 6
jadi rumus molekul yang dimiliki senyawa tersebut adalah (CH)n = C6H6.
Sekian kimiaker, mohon maaf apabila ada kesalahan, terimakasih telah berkunjung.
By : Dede Taufiq
Sekian kimiaker, mohon maaf apabila ada kesalahan, terimakasih telah berkunjung.
By : Dede Taufiq

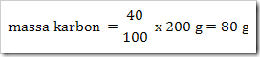
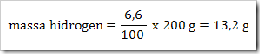







Tidak ada komentar:
Posting Komentar